إجابات مراجعة الوحدة الثانية
السؤال الأول:
أقارن بين الخلية الجلفانية وخلية التحليل الكهربائي، من حيث:
أ- تحولات الطاقة في كل منهما.
ب- شحنة كل من المصعد والمهبط.
ج- تلقائية تفاعل التأكسد والاختزال.
د- إشارة جهد الخلية المعياري Eocell .
|
وجه المقارنة |
الخلية الجلفانية |
خلية التحليل الكهربائي |
|
تحولات الطاقة في كل منهما |
من كيميائية إلى كهربائية |
من كهربائية إلى كيميائية |
|
شحنة كل من المصعد والمهبط |
المصعد (-)، والمهبط (+) |
المصعد (+)، والمهبط (-) |
|
تلقائية تفاعل التأكسد والاختزال |
تلقائي |
غير تلقائي |
|
إشارة جهد الخلية المعياري Eocell |
موجبة |
سالبة |
السؤال الثاني:
أفسر:
أ- يخلط أكسيد الألمنيوم Al2O3 بالكريوليت خلال عملية استخلاص الألمنيوم بطريقة هول - هيرولت.
لتخفيض درجة انصهاره.
ب- تفقد بطارية السيارة صلاحيتها بعد بضع سنوات من استخدامها، رغم إمكانية إعادة شحنها نظرياً عدداً لا نهائياً من المرات.
تفقد بطارية السيارة صلاحيتها نتيجة فقدان جزء من مكوناتها، مثل PbSO4 ونتيجة للحركة المستمرة للمركبات على الطرق، التي تؤدي إلى تساقطه عن ألواح الرصاص، ومن ثم عدم دخوله في التفاعل العكسي، إضافة إلى استهلاك حمض الكبريتيك ونقصان كثافته.
السؤال الثالث:
تمثل المعادلة الكيميائية الآتية تفاعل تأكسد واختزال، أدرسه جيداً، ثم أجيب عن الأسئلة التي تليه:
MnO4-(aq) + Cl-(aq) → Mn2+(aq) + Cl2(g)
أ- أكتب نصفي تفاعل التأكسد والاختزال.
نصف تفاعل التأكسد: 2Cl- → Cl2 + 2e-
نصف تفاعل الاختزال: MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
ب- أكتب معادلة التفاعل الكلي الموزونة (وسط حمضي).
2MnO4- + 16H+ + 10Cl- → 2Mn2+ + 5Cl2 + 8H2O
ج- هل يحدث هذا التفاعل تلقائياً؟ (أستعين بجدول جهود الاختزال المعيارية)
يحدث التفاعل تلقائياً؛ لأن جهد التفاعل المعياري (+0.15 V).
السؤال الرابع:
أدرس معادلة التفاعل الكيميائي، التي تتضمن رموزاً افتراضية للفلز X واللافلز Y وعنصر الهيدروجين، ثم أجيب عن الأسئلة التي تليها:
2X(s) + 3H2Y → X2Y3 + 3H2(g)
أ- أحدد التغير في عدد تأكسد X .
(3).
ب- أحدد التغير في عدد تأكسد H .
(1).
ج- أحدد العامل المؤكسد.
H2Y
السؤال الخامس:
أوازن معادلات التأكسد والاختزال الآتية بطريقة نصف التفاعل، وأحدد العامل المؤكسد والعامل المختزل.
أ- 2H2O + 3MnO42- → 2MnO4- + MnO2 + 4OH-
العامل المؤكسد (MnO42-)، العامل المختزل (MnO42-).
ب- 2H+ + S2O32- + 2IO3- + 4Cl- → 2SO42- + 2ICl2- + H2O
العامل المؤكسد (IO3-)، العامل المختزل (S2O32-).
السؤال السادس:
خلية جلفانية مكونة من نصف خلية الرصاص Pb2+│Pb ونصف خلية الكروم Cr3+│Cr . إذا علمت أن تركيز أيونات Cr3+ يزداد عند تشغيل الخلية، فأجيب عمّا يأتي:
أ- أحدد المصعد والمهبط في الخلية الجلفانية.
المصعد (Cr)، المهبط (Pb).
ب- أتوقع التغير في كتلة قطب الرصاص مع استمرار تشغيل الخلية.
تزداد.
ج- أكتب معادلة موزونة تمثل التفاعل الكلي الذي يحدث في الخلية.
2Cr + 3Pb2+ → 2Cr3+ + 3Pb
د- أحسب، مُستعيناً بجدول جهود الاختزال المعيارية، جهد الخلية المعياري (Eocell).
E0cell = E0(cathode) – E0(anode)
E0cell = - 0.13 – (- 0.73) = 0.60 V
السؤال السابع:
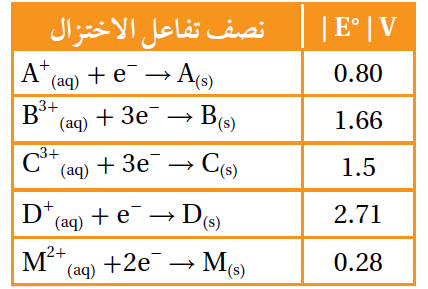 يبين الجدول المجاور القيم المطلقة لجهود الاختزال المعيارية Eo للعناصر (A, B, C, D, M). إذا علمت أن ترتيب العناصر حسب قوتها كعوامل مختزلة، هو: D>B>M>A>C ، وأنه عند وصل القطب M بقطب الهيدروجين المعياري تتحرك الإلكترونات من M إلى قطب الهيدروجين، فأجيب -مستعيناً بالمعلومات السابقة- عن الأسئلة الآتية:
يبين الجدول المجاور القيم المطلقة لجهود الاختزال المعيارية Eo للعناصر (A, B, C, D, M). إذا علمت أن ترتيب العناصر حسب قوتها كعوامل مختزلة، هو: D>B>M>A>C ، وأنه عند وصل القطب M بقطب الهيدروجين المعياري تتحرك الإلكترونات من M إلى قطب الهيدروجين، فأجيب -مستعيناً بالمعلومات السابقة- عن الأسئلة الآتية:
أ- أكتب إشارة قيم جهود الاختزال المعيارية Eo للعناصر A, B, C, D, M .
D (-2.71)، B (-1.66)، M (-0.28)، A (+0.80)، C (+1.5).
ب- أستنتج. ما العنصر الذي يمكن استخدام وعاء مصنوع منه لحفظ محلول يحتوي على أيونات A+ ؟
C
ج- أستنتج. ما العامل المؤكسد الذي يؤكسد D ولا يؤكسد M ؟
B3+
السؤال الثامن:
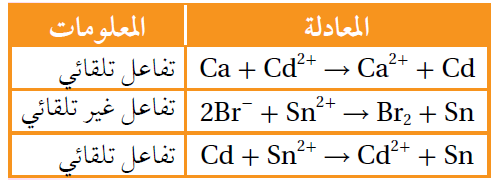 أدرس المعادلات والمعلومات المبينة في الجدول؛ ثم أجيب عن الأسئلة التي تليها:
أدرس المعادلات والمعلومات المبينة في الجدول؛ ثم أجيب عن الأسئلة التي تليها:
أ- أحدد أقوى عامل مؤكسد.
Br2
ب- أرتب العوامل المختزلة تصاعدياً حسب قوتها.
Ca>Cd>Sn>Br-
ج- أستنتج. هل تؤكسد أيونات الكادميوم Cd2+ أيونات البروم Br- ؟
لا يمكن.
د- أقارن. ما العنصران اللذان يكونان خلية جلفانية لها أعلى جهد خلية معياري؟
Ca/Br2
السؤال التاسع:
خلية تحليل كهربائي تحتوي على محلول بروميد الليثيوم LiBr . بالرجوع إلى جدول جهود الاختزال المعيارية، أجيب عن الأسئلة الآتية:
أ- أكتب معادلة التفاعل الذي يحدث عند المصعد.
2Br-(aq) → Br2(l) + 2e-
ب- أستنتج. ما ناتج التحليل الكهربائي عند المهبط؟
تصاعد غاز H2 ، وتكون وسط قاعدي.
ج- أحسب. ما مقدار جهد البطارية اللازم لإحداث عملية التحليل الكهربائي؟
E0cell = E0(cathode) – E0(anode)
E0cell = - 0.83 – (1.06) = 1.89 V
جهد البطارية قيمة تزيد على (1.89 V).
السؤال العاشر:
عند استخدام آلة تصوير ذات بطارية قابلة لإعادة الشحن، أجيب عن الأسئلة الآتية:
أ- أقارن تحولات الطاقة خلال عمليتي الاستخدام والشحن.
خلال الاستخدام تتحول الطاقة من كيميائية إلى كهربائية، وخلال الشحن تتحول من كهربائية إلى كيميائية.
ب- أفسر. تعمل هذه البطارية كخلية جلفانية وخلية تحليل كهربائي.
خلال الاستخدام تعمل كخلية جلفانية؛ لأنها تنتج طاقة، وخلال الشحن تعمل كخلية تحليل كهربائي؛ لأنها تحتاج إلى طاقة.
السؤال الحادي عشر:
أدرس المعلومات الآتية المتعلقة بالفلزات ذات الرموز الافتراضية الآتية: C,Z,B,X,A,Y ، ثم أجيب عن الأسئلة التي تليها:
أ- الفلز A يختزل أيونات X2+ ولا يختزل أيونات Y2+ .
ب- عند مفاعلة الفلزين X , B مع محلول حمض الهيدروكلوريك المخفف، يتفاعل X وينطلق غاز الهيدروجين، أمّا B فلا يتفاعل.
ج- عند تكوين خلية جلفانية من الفلزين C و Y ، تتحرك الأيونات السالبة من القنطرة الملحية باتجاه نصف خلية C .
د- يمكن استخلاص الفلز Z من محاليل أملاحه باستخدام الفلز B .
1) أستنتج اتجاه حركة الإلكترونات في الخلية المكونة من القطبين C , X .
من قطب (C) إلى قطب (X).
2) أستنتج القطب الذي تزداد كتلته في الخلية المكونة من القطبين A , B .
القطب (B).
3) أقارن. ما القطبان اللذين يشكلان خلية جلفانية لها أعلى جهد خلية معياري؟
القطب (C)، والقطب (Z).
4) أتنبأ. هل يمكن تحضير الفلز Z بالتحليل الكهربائي لمحلول ZNO3 ؟ أفسر إجابتي.
نعم يمكن؛ لأن جهد اختزاله أعلى من جهد اختزال الماء.
5) أستنتج. هل يتفاعل الفلز A مع محلول حمض الهيدروكلوريك وينطلق غاز الهيدروجين؟ أفسر إجابتي.
نعم يتفاعل؛ لأن جهد اختزاله أقل من جهد اختزال الهيدروجين.
6) أتنبأ. هل يمكن تحريك محلول نترات الفلز Y(NO3)2 بملعقة من الفلز B ؟
نعم يمكن.
السؤال الثاني عشر:
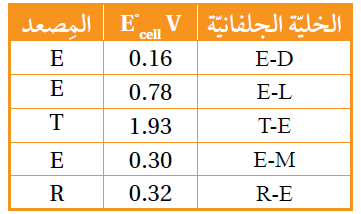 استخدمت أنصاف الخلايا المعيارية للفلزات ذات الرموز الافتراضية الآتية: T,R,D,M,L ، مع نصف خلية الفلز E المعيارية لتكوين خلايا جلفانية، وكانت النتائج كما في الجدول الآتي. أدرسه جيداً، ثم أجيب عن الأسئلة الآتية:
استخدمت أنصاف الخلايا المعيارية للفلزات ذات الرموز الافتراضية الآتية: T,R,D,M,L ، مع نصف خلية الفلز E المعيارية لتكوين خلايا جلفانية، وكانت النتائج كما في الجدول الآتي. أدرسه جيداً، ثم أجيب عن الأسئلة الآتية:
أ- أرتب الفلزات متضمنة الفلز E حسب قوتها كعوامل مختزلة.
T>R>E>D>M>L
ب- أحسب جهد الخلية المعياري Eocell للخلية المكونة من الفلزين T,R
1.61 V
ج- أقارن. ما الفلزان اللذان يشكلان خلية جلفانية لها أعلى جهد خلية معياري؟
T/L
د- أستنتج. هل يمكن حفظ محلول أحد أملاح الفلز D في وعاء من الفلز R ؟ أفسر إجابتي.
لا يمكن؛ لأن جهد اختزال R أقل من جهد اختزال D
السؤال الثالث عشر:
أختار الإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1- المادة التي اختزلت في التفاعل الآتي: TiO2 + 2Cl2 + C → TiCl4 + CO2 ، هي:
أ- C
ب- Cl2
ج- TiO2
د- TiCl4
2- عدد تأكسد البورون B في المركب NaBH4 يساوي:
أ- +3
ب- +5
ج- -5
د- -3
3- إحدى العبارات الآتية صحيحة:
أ- العامل المختزل يكتسب إلكترونات في التفاعل الكيميائي.
ب- العامل المؤكسد يفقد إلكترونات في التفاعل الكيميائي.
ج- تحتوي جميع تفاعلات التأكسد والاختزال على عامل مؤكسد وعامل مختزل.
د- يحتوي تفاعل التأكسد والاختزال على عامل مؤكسد وعامل مختزل فقط.
4- العبارة الصحيحة في معادلة التفاعل الموزونة الآتية:
IO3- + 5I- + 6H+ → 3I2 + 3H2O ، هي:
أ- عدد تأكسد اليود في IO3- يساوي +7
ب- العامل المؤكسد في التفاعل هو I- .
ج- يعد التفاعل تأكسداً واختزالاً ذاتياً.
د- تأكسدت ذرات اليود (أو أيوناته) واختزلت في التفاعل.
5- التفاعل الذي يسلك فيه الهيدروجين كعامل مؤكسد هو:
أ- H2 + Cl2 → 2HCl
ب- Cu2+ + H2 → Cu + 2H+
ج- H2 + 2Na → 2NaH
د- HCHO + H2 → CH3OH
6- مقدار التغير في عدد تأكسد الكربون (C)، عند تحول الأيون C2O42- إلى جزيء CO2 هي:
أ- 0
ب- 1
ج- 2
د- 4
7- أحد التغيرات الآتية يحتاج إلى عامل مؤكسد:
أ- PbO2 → Pb2+
ب- CrO42- → Cr(OH)4-
ج- BiO+ → Bi
د- H2O2 → O2
8- أحد التفاعلات غير الموزونة الآتية يمثل تفاعل تأكسد واختزال ذاتي:
أ- NO + O2 → NO2
ب- H2O + NO2 → HNO3 + NO
ج- MnO4- + Mn2+ → MnO2
د- OF2 + H2O → O2 + HF
9- عدد مولات الإلكترونات اللازمة لموازنة نصف التفاعل الآتي في وسط حمضي FeO42- → Fe3+ هو:
أ- 2
ب- 4
ج- 3
د- 1
10- عدد مولات أيونات الهيدروكسيد OH- اللازم إضافتها إلى طرفي المعادلة لموازنة التفاعل الآتي في وسط قاعدي:
MnO4- + H2O2 → MnO2 + O2 هو:
أ- 8OH-
ب- 6OH-
ج- 4OH-
د- 2OH-
11- إذا كان التفاعل الآتي يحدث في إحدى الخلايا الجلفانية
A + B2+ → A2+ + B ، فإن:
أ- القطب السالب هو B
ب- كتلة القطب A تزداد.
ج- تركيز أيونات A2+ يزداد.
د- الإلكترونات تتحرك من القطب B إلى القطب A
-
 يتضمن الجدول المجاور ثلاث خلايا جلفانية يشكل الفلز X أحد أقطابها مع أحد الفلزات ذات الرموز الافتراضية M,N,L ومعلومات عنها. أدرسه جيداً، ثم أجيب عن الأسئلة 12 و 13 و 14 .
يتضمن الجدول المجاور ثلاث خلايا جلفانية يشكل الفلز X أحد أقطابها مع أحد الفلزات ذات الرموز الافتراضية M,N,L ومعلومات عنها. أدرسه جيداً، ثم أجيب عن الأسئلة 12 و 13 و 14 .
12- أرتب الفلزات X,L,N,M حسب قوتها كعوامل مختزلة:
أ- X>L>N>M
ب- M>X>N>L
ج- M>N>L>X
د- L>N>X>M
13- جهد الخلية M-N المعياري Eocell بالفولت يساوي:
أ- 0.63
ب- 0.93
ج- 0.04
د- 0.59
14- الفلز الذي يمكن حفظ محلول أحد أملاحه في وعاء مصنوع من أيّ من الفلزات الثلاثة المتبقية، هو:
أ- X
ب- L
ج- N
د- M
15- الفلز الذي يوفر لجسر حديدي أفضل حماية مهبطية من التآكل:
أ- Au
ب- Sn
ج- Mg
د- Cu
-
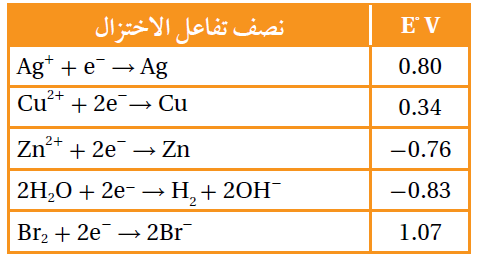 أدرس الجدول المجاور، الذي يتضمن بعض أنصاف تفاعلات الاختزال المعيارية وجهودها، وأستخدمه للإجابة عن الأسئلة 16 و 17 .
أدرس الجدول المجاور، الذي يتضمن بعض أنصاف تفاعلات الاختزال المعيارية وجهودها، وأستخدمه للإجابة عن الأسئلة 16 و 17 .
16- عند التحليل الكهربائي لمحلول بروميد الخارصين، فإن الناتج عند المهبط هو:
أ- Zn
ب- H2
ج- Cl2
د- OH-
17- عند التحليل الكهربائي لمحلول يحتوي على الأيونات Cu2+ , Zn2+ , Ag+ ، فإن ذراتها تبدأ بالترسب عند المهبط حسب الترتيب الآتي:
أ- Zn→Ag→Cu
ب- Cu→Ag→ Zn
ج- Ag→Cu→Zn
د- Ag→Zn→Cu
18- عندما يعاد شحن بطارية قابلة لإعادة الشحن تعمل الخلية كخلية:
أ- حمضية.
ب- قلوية.
ج- جلفانية.
د- تحليل كهربائي.
19- جميع العبارات الآتية صحيحة، بالنسبة إلى الخلية الجلفانية Ni│Ni2+│Ba2+│Ba ، ما عدا:
أ- Ni2+ أقوى عامل مؤكسد.
ب- Ba أقوى عامل مختزل.
ج- تزداد كتلة القطب Ni
د- Ba│Ba2+ تمثل نصف خلية الاختزال.
20- العبارة الخاطئة من العبارات الآتية التي تصف ما يحدث في بطارية أيون الليثيوم خلال عملية شحن البطارية، هي:
أ- تتأكسد أيونات الكوبالت Co3+ إلى Co4+ .
ب- يمثل أكسيد الكوبالت CoCl2 قطب المهبط في أثناء الشحن.
ج- تختزل أيونات الليثيوم Li+
د- تتحرك أيونات الليثيوم Li+ باتجاه نصف خلية الجرافيت.
إعداد : شبكة منهاجي التعليمية
25 / 06 / 2023
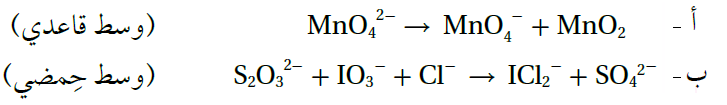
النقاشات