التحليل الكهربائي لمصاهير المواد الأيونية
يتم تحليل مصهور أي مادة أيونية وفق الخطوات التالية:
1- تعمل الحرارة على تفكيك المركب الأيوني إلى أيونات سالبة وأيونات موجبة.
2- تدفع البطارية الإلكترونات إلى المصهور عن طريق القطب السالب.
3- تتحرك الأيونات المختلفة نحو الأقطاب المخالفة لها في الشحنة.
4- يحدث اختزال للأيونات الموجبة على المهبط بفعل الإلكترونات القادمة من البطارية.
5- يحدث تأكسد للأيونات السالبة على المصعد.
6- تخرج الإلكترونات من المصعد لتعود إلى البطارية ثانية وتكمل دورتها.
مثال (1):
خلية تحليل كهربائي تحتوي مصهور كلوريد الصوديوم NaCl وأقطابها من الجرافيت، أجيب عمّا يلي:
1- أكتب أنصاف التفاعلات التي تحدث عند القطبين، والتفاعل الكلي.
2- ما نواتج التحليل الكهربائي للمصهور؟
3- أحسب جهد الخلية المعياري (Eocell) إذا علمت أن (جهد اختزال الصوديوم = -2.71 V، جهد اختزال الكلور = 1.36 V).
الحل:
يتفكك المركب الأيوني بالحرارة وفق المعادلة:
NaCl Na+ + Cl-
يتجه أيون الصوديوم إلى المهبط ويحدث له اختزال بفعل الإلكترونات القادمة من البطارية.
نصف تفاعل الاختزال/ المهبط Na+ (aq) + e- → Na (s)
يتجه أيون الكلوريد إلى المصعد ويحدث له تأكسد، وتتحد كل ذرتين منها لتكون جزيئاً من جزيئات الكلور.
نصف تفاعل التأكسد/المصعد 2Cl- (aq) → Cl2 (g) + 2e-
تعود الإلكترونات الخارجة من المصعد إلى البطارية مجدداً.
نواتج التحليل الكهربائي:
1- تصاعد غاز الكلور Cl2 على المصعد.
2- تكون الصوديوم Na على المهبط.
ولحساب جهد الخلية:
Eocell = EoNa(cathode) – EoCl2(anode)
Eocell = -2.71 – 1.36 = -4.07 V
لاحظ أن إشارة جهد الخلية (oE) سالبة، وهذا يعني أن التفاعل غير تلقائي، ولا يمكن حدوثه إلا بتزويد الخلية بفرق جهد يزيد على 4.07 V
تستخدم عملية تحليل مصهور NaCl كهربائياً لاستخلاص الصوديوم صناعياً، كما تُستخلص معظم الفلزات النشطة، كالليثيوم والبوتاسيوم غالباً من كلوريدات مصاهيرها بالتحليل الكهربائي.
سؤال (1):
عند تحليل مصهور كلوريد الألمنيوم AlCl3 كهربائياً باستخدام أقطاب من الجرافيت:
1- أكتب المعادلات التي تحدث على كلّ من المصعد والمهبط .
2- أكتب التفاعل الخلوي (الكلي).
3- ما عدد مولات الألمنيوم الناتجة إلى الكلور؟
4- ما نواتج التحليل الكهربائي؟
5- أكتب الدقائق الموجود في خلية التحليل قبل عملية التحليل وبعدها.
6- أوضح اتجاه حركة الأيونات في خلية التحليل.
سؤال (2):
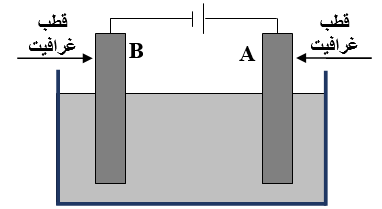 اعتماداً على الشكل المجاور الذي يبين خلية تحليل كهربائي لمصهور يوديد النيكل NiI2 . أجيب عما يأتي:
اعتماداً على الشكل المجاور الذي يبين خلية تحليل كهربائي لمصهور يوديد النيكل NiI2 . أجيب عما يأتي:
1- أي القطبين (A أم B) يمثل المهبط؟ وما إشارته؟
2- أكتب أنصاف التفاعلات التي تحدث عند قطبي الخلية.
3- ما نواتج التحليل الكهربائي؟
4- ما تحولات الطاقة في هذه الخلية؟
5- إذا كان جهد البطارية (1.5 V) فهل تتوقع حدوث تفاعلات تأكسد واختزال؟ أفسّر إجابتي اعتماداً على جهود الاختزال التالية: (جهد اختزال النيكل = -0.23 V، جهد اختزال اليود = +0.54 V).
سؤال (3):
خلية تحليل كهربائي تحتوي مصهور كلوريد المغنيسيوم MgCl2 .
1- أكتب أنصاف التفاعلات التي تحدث عند القطبين.
2- ما نواتج التحليل الكهربائي للمصهور؟
3- ما مقدار جهد البطارية اللازم لحدوث التفاعل في الخلية.
(إذا علمت أن جهد اختزال المغنيسيوم = -2.37 V، جهد اختزال الكلور = +1.36 V).
4- إذا ربطت أقطاب خلية التحليل السابقة بأقطاب خلية جلفانية تتكون من قطبي النيكل والخارصين، فهل تكفي كمية الكهرباء الناتجة من الخلية الجلفانية لإحداث تفاعلات كيميائية في خلية التحليل؟
(إذا علمت أن جهد اختزال النيكل = -0.23 V، جهد اختزال الخارصين = -0.76 V).
سؤال (5):
عند تحليل مخلوط من مصهور يوديد النحاس CuI2 ويوديد الخارصين ZnI2 كهربائياً باستخدام أقطاب جرافيت:
أكتب التفاعلات التي تحدثً عند كل قطب.
علماً بأن جهد اختزال النحاس = 0.34 V، وجهد اختزال الخارصين = -0.76 V
إعداد : شبكة منهاجي التعليمية
09 / 12 / 2022
النقاشات