تأثير الأيون المشترك
Common Ion Effect
الأيون المشترك: أيون يدخل في تركيب مادتين مختلفتين (حمض ضعيف وملح، أو قاعدة ضعيفة وملح)، وينتج من تأينهما.
في هذا الدرس سندرس أثر إضافة الملح إلى محلول الحمض، وأثر إضافة الملح إلى محلول القاعدة، وهو ما يعرف بتأثير الأيون المشترك.
تأثير الأيون المشترك: التغير في تراكيز المواد والأيونات الناتج من إضافة الملح إلى المحلول.
في هذا الدرس سنتعامل مع حالتين، هما:

الحالة الأولى: (الأثر القاعدي للأيون المشترك)
ماذا يحدث لقيمة pH عند إضافة محلول سيانيد الصوديوم NaCN (ملح قاعدي) إلى محلول حمض الهيدروسيانيكHCN (حمض ضعيف)؟
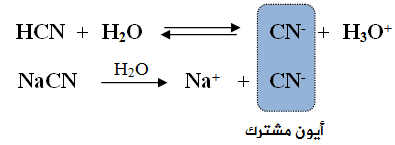 يتحلل حمض الهيدروسيانيك في الماء وفق المعادلة:
يتحلل حمض الهيدروسيانيك في الماء وفق المعادلة:
يتحلل ملح سيانيد الصوديوم في الماء وفق المعادلة:
قبل إضافة الملح NaCN إلى محلول الحمض الضعيف HCN ، تكون أيونات H3O+ و CN- في حالة اتزان مع جزيئات HCN في محلول الحمض، وتركيزهما متساوٍ.
عند إضافة الملح NaCN إلى محلول الحمض الضعيف HCN ، يتأين الملح كلياً في الماء، فيعمل على زيادة تركيز الأيون المشترك (CN-)، ونتيجة لذلك سوف يندفع الاتزان في معادلة الحمض الضعيف باتجاه اليسار (المتفاعلات)، ما يزيد من تركيز الحمض الضعيف، ويقلل تأينه، كما يقلل من تركيز أيونات H3O+ ، وزيادة قيمة pH .
الحالة الأولى: (الأثر الحمضي للأيون المشترك)
ماذا يحدث لقيمة pH عند إضافة ملح كلوريد الأمونيوم NH4Cl (ملح حمضي) إلى محلول الأمونياNH3 (قاعدة ضعيفة)؟
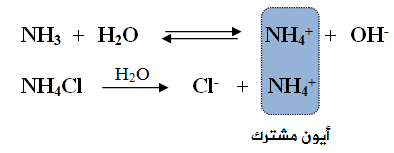 تتحلل الأمونيا في الماء وفق المعادلة:
تتحلل الأمونيا في الماء وفق المعادلة:
يتحلل ملح كلوريد الأمونيوم في الماء وفق المعادلة:
قبل إضافة الملح NH4Cl إلى محلول القاعدة الضعيفة NH3، تكون أيونات NH4+ و OH- في حالة اتزان مع جزيئات NH3 في محلول القاعدة، وتركيزهما متساوٍ.
عند إضافة الملح NH4Cl إلى محلول القاعدة الضعيفة NH3 ، يتأين الملح كلياً في الماء، فيعمل على زيادة تركيز الأيون المشترك (NH4+)، ونتيجة لذلك سوف يندفع الاتزان في معادلة القاعدة الضعيفة باتجاه اليسار (المتفاعلات)، ما يزيد من تركيز القاعدة الضعيفة، ويقلل تأينها، كما يقلل من تركيز أيونات OH- ، ونقصان قيمة pH .
سؤال (1):
أضيف محلول ملح NaNO2 إلى محلول الحمض HNO2 .
1- اكتب صيغة الأيون المشترك.
2- ماذا يحدث لتركيز أيون الهيدرونيوم؟
3- ماذا يحدث لتركيز أيون الهيدروكسيد؟
4- ماذا يحدث لقيمة pH ؟
5- ماذا يحدث لقيمة Ka ؟
6- أين يتجه الاتزان في معادلة الحمض بعد إضافة الملح؟
7- ماذا يحدث لـ [HNO2] بعد إضافة الملح؟
8- ماذا يحدث لتأين الحمض بعد إضافة الملح؟
سؤال (2):
أضيف محلول ملح N2H5NO3 إلى محلول القاعدة N2H4 .
1- اكتب صيغة الأيون المشترك.
2- ماذا يحدث لتركيز أيون الهيدروكسيد؟
3- ماذا يحدث لتركيز أيون الهيدرونيوم؟
4- ماذا يحدث لقيمة pH ؟
5- ماذا يحدث لقيمة Kb ؟
6- أين يتجه الاتزان في معادلة القاعدة بعد إضافة الملح؟
7- ماذا يحدث لـ [N2H4] بعد إضافة الملح؟
8- ماذا يحدث لتأين القاعدة بعد إضافة الملح؟
سؤال (3):
اكتب صيغة مادتان تنجان الأيونات المشتركة التالية في محاليلها:
أ- CH3NH3+
ب- C2H5COO-
ج- C5H5NH+
د- NH2OH2+
الحسابات المتعلقة بالأيون المشترك
الأثر القاعدي للأيون المشترك
مثال (1):
أحسب التغير في الرقم الهيدروجيني لمحلول الحمض الضعيف CH3COOH ، الذي تركيزه 0.1 M ورقمه الهيدروجيني pH = 2.9 إذا أضيف إلى لتر منه 0.2 mol من ملح إيثانوات الصوديوم CH3COONa . علماً أن Ka = 1.7 x 10-5 و log 8.5 = 0.93
الحل:
أحسب تركيز الملح المضاف:
M = = = 0.2 M
يتأين الحمض الضعيف وفق المعادلة:
+ H3O+ CH3COOH + H2O CH3COO-
ويكون [CH3COO-] = [H3O+]
وعند إضافة الملح CH3COONa إلى محلول الحمض، يتأين الملح وفق المعادلة:
+ Na+ CH3COONa CH3COO-
وللأيون المشترك CH3COO- الناتج من إضافة الملح إلى محلول الحمض مصدران:
1- الحمض الضعيف، وكميته قليلة، فيهمل.
2- الملح المضاف؛ ولأن تأين الملح كلي، فيمكن اعتباره المصدر الوحيد في المحلول.
أي أن: [CH3COO-] = [CH3COONa] = 0.2 M
أعوض تركيز الحمض وتركيز الأيون المشترك من الملح وقيمة Ka في العلاقة:
Ka =
1.7 x 10-5 =
[H3O+] = 8.5 x 10-6 M
pH2 = - log [H3O+] = -log (8.5 x 10-6) = 6 – (0.93) = 5.07
ΔpH = pH2 – pH1 = 5.07 – 2.9 = 2.17
وهذا يعني أن الرقم الهيدروجيني زاد بمقدار (2.17) بعد إضافة الملح القاعدي إلى محلول الحمض الضعيف.
مثال (2):
أحسب الرقم الهيدروجيني لمحلول مكون من الحمض HNO2 تركيزه 0.085 M والملح KNO2 0.1 M
علماً أن Ka = 4.5 x 10-4 و log 3.825 = 0.58
الحل:
يتأين الحمض الضعيف وفق المعادلة:
+ H3O+ HNO2 + H2O NO2-
ويكون [NO2-] = [H3O+]
وعند إضافة الملح KNO2 إلى محلول الحمض، يتأين الملح وفق المعادلة:
+ K+ KNO2 NO2-
نعتبر أن المصدر الوحيد للأيون المشترك NO2- من الملح.
أي أن: [NO2-] = [KNO2] = 0.1 M
أعوض تركيز الحمض وتركيز الأيون المشترك من الملح وقيمة Ka في العلاقة:
Ka =
4.5 x 10-4 =
[H3O+] = 3.825 x 10-4 M
pH2 = - log [H3O+] = - log (3.825 x 10-4) = 4 – (0.58) = 3.42
الأثر الحمضي للأيون المشترك
مثال (3):
أحسب التغير في الرقم الهيدروجيني لمحلول الأمونيا NH3 ، الذي حجمه 1 L وتركيزه 0.1 M ورقمه الهيدروجيني يساوي 11 إذا أضيف إليه 0.2 mol من ملح كلوريد الأمونيوم NH4Cl .
علماً أن Kb = 1.8 x 10-5 , log 1.1 = 0.04
الحل:
أحسب تركيز الملح المضاف:
M = = = 0.2 M
تتأين القاعدة الضعيفة وفق المعادلة:
+ OH- NH3 + H2O NH4+
يتأين الملح NH4Cl وفق المعادلة:
+ Cl- NH4Cl NH4+
أعوض تركيز القاعدة وتركيز الأيون المشترك من الملح وقيمة Kb في العلاقة:
Kb =
1.8 x 10-5 =
[OH-] = 0.9 x 10-5 M
[OH-] [H3O+] = 1 x 10-14 Kw =
[H3O+] = = = 1.1 x 10-9 M
[H3O+] = 1.1 x 10-9 M
pH2 = - log [H3O+] = -log (1.1 x 10-9) = 9 – (0.04) = 8.96
أحسب التغير في قيمة الرقم الهيدروجيني:
ΔpH = pH2 – pH1 = 8.96 – 11 = -2.04
الإشارة السالبة تعني نقصان في قيمة pH .
سؤال (4):
أحسب التغير على قيمة pH عند إضافة 0.4 M من ملح إيثانوات البوتاسيوم CH3COOK إلى محلول حمض الإيثانويك CH3COOH بتركيز 0.2 M (Ka = 2 x 10-5)، (log 2 = 0.3).
سؤال (5):
أحسب التغير في قيمة الرقم الهيدروجيني لمحلول الأمونيا NH3 تركيزه 0.2 M إذا أضيف إليه ملح كلوريد الأمونيوم NH4Cl بتركيز 0.2 M علماً أن Kb = 2 x 10-5 و log 5 = 0.7
سؤال (6):
1- أحسب قيمة pH لمحلول تركيزه 0.01 Mمن القاعدة N2H4 (Kb = 1 x 10-6).
2- أحسب قيمة pH للمحلول السابق إذا أضيف إلى لتر منه 0.01 mol من الملح N2H5NO3 .
سؤال (7):
إذا كانت قيمة pH لمحلول مكوّن من الحمض HA والملح KA لهما التركيز نفسه تساوي (4)، أحسب قيمة Ka للحمض.
سؤال (8):
حُضر محلول من قاعدة ضعيفة (B) والملح (BHCl) بالتركيز نفسه، فإذا علمت أن Kb لـ B = (1 x 10-4). أحسب قيمة pH للمحلول الناتج.
سؤال (9):
محلول من حمض HNO2 تركيزه (0.1 M)، أضيفت إليه بلورات من ملح NaNO2 فأصبحت قيمة pH = (4). أحسب تركيز الملح المضاف بوحدة (M). (أهمل تغيّر الحجم، Ka للحمض HNO2 = 4 x 10-4)
سؤال (10):
أضيف (0.09 mol) من الملح KZ إلى (250 mL) من محلول الحمض HZ (0.1 M). أحسب قيمة pH للمحلول الناتج. Ka لـ HZ = (3.6 x 10-6)
سؤال (11):
محلول يتألف من حمض HOCl وملح NaOCl ، فإذا كان تركيز الملح ضعفي تركيز الحمض، إذا علمت أن قيمة ثابت تأين الحمض= 2 x 10-8 Ka . أحسب قيمة pH للمحلول.
سؤال (12):
إذا كان لديك محلولاً للحمض HA بتركيز 0.1 M، وأضيف إلى لتر منه ملح KA فكان التغير في قيمة pH تساوي (1)، فأوجد كتلة الملح المضاف إذا علمت أن Ka للحمض = 1 x 10-5 ، والكتلة المولية للملح = 40 g/mol
سؤال (13):
محلول حمض الميثانويك HCOOH حجمه (500 mL)، وتركيزه (0.5 M)، أضيفت إليه بلورات من ملح ميثانوات الصوديوم HCOONa ، كتلته المولية (68 g/mol)، فتغيرت قيمة pH بمقدار (2)، فإذا علمت أن Ka للحمض (2 x 10-4)، أحسب كتلة بلورات الملح المضافة بوحدة (g).
سؤال (14):
عند إضافة عدد معين من مولات ملح إيثانوات الصوديومCH3COONa إلى لتر من محلول حمض الإيثانويك CH3COOH بتركيز (0.2 M)، تغيرت قيمة pH المحلول بمقدار 2.3 . أحسب تركيز الملح المضاف.
(log 2 = 0.3) (Ka للحمض = 2 x 10-5)
سؤال (15):
أضيف ملح C6H5NH3Cl إلى لتر من محلول C6H5NH2 بتركيز (0.01 M) فتغيرت قيمة (pH) بمقدار (-0.3). أحسب كتلة الملح المضاف علماً أن الكتلة المولية للملح تساوي (130 g/mol)، وثابت تأين القاعدة C6H5NH2 (Kb) = 4 x 10-10 ، (log 5 = 0.7). بافتراض أن حجم المحلول لم يتغير.
سؤال (16):
أضيف 0.1 mol من ملح NH4Cl إلى لتر من محلول NH3 فأصبحت قيمة pH = (9). أحسب قيمة pH للقاعدة قبل إضافة الملح. (أهمل التغير في الحجم بعد إضافة الملح)
سؤال (17):
أضيفت بلورات من ملح KA إلى محلول الحمض HA فتغيرت قيمة pH من (2) إلى (5). أحسب تركيز الملح (أهمل التغير في الحجم بعد إضافة الملح).
سؤال (18):
إذا كانت قيمة pH في محلول يحتوي على 0.1 M من حمض HX = (3)، أحسب تركيز الملح NaX الذي يجب أن يضاف للمحلول لتتغير قيمة pH بمقدار (2).
إعداد : أ. أحمد الحسين
31 / 10 / 2022
النقاشات