أسئلة وزارية (الحموض والقواعد)
الدورات (2011-2015)
الدورة الشتوية 2011
أ) انقل إلى دفتر إجابتك الفقرة الآتية والإجابة الصحيحة لها:
1) عند معايرة حمض وقاعدة قويين تكون قيمة pH عند نقطة التكافؤ:
أ) 5
ب) 9
ج) 1
د) 7
2) قاعدة لويس فيما يلي هي:
أ) B(OH)3
ب) NCl3
ج) NH4+
د) Fe3+
ب) اعتماداً على المعلومات الآتية لعدد من محاليل الحموض الضعيفة المتساوية في التركيز (0.01 M)، أجب عن الأسئلة الآتية:
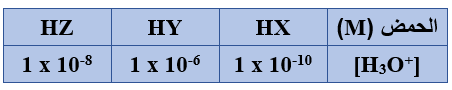
1) ما صيغة القاعدة المرافقة الأقوى؟
X-
2) ما صيغة الحمض الذي في محلوله [OH-] الأقل؟
HY
3) ما قيمة Ka للحمض HY ؟
1 x 10-4
4) عند تفاعل HX مع Z- حدد الجهة التي يرجحها الاتزان.
يرجح الاتزان جهة المتفاعلات.
ج) اكتب معادلة تأين H2PO4- كحمض في الماء.
H2PO4- + H2O HPO42- + H3O+
د) محلول مكون من 0.2 M RCOOH ، (Ka له 1 x 10-5) و 0.4 M RCOONa ، أجب عن الأسئلة الآتية:
1) اكتب معادلتي تأين الحمض والملح في الماء.
RCOOH + H2O RCOO- + H3O+
RCOONa RCOO- + Na+
2) ما صيغة الأيون المشترك؟
RCOO-
3) احسب pH للمحلول عند إذابة (0.1 mol) من HCl في لتر من المحلول (أهمل تغير الحجم).
أحسب تركيز الحمض HCl من عدد مولاته وحجمه:
M = n x V = 0.1 x 1 = 0.1 mol
Ka =
1 x 10-5 =
[OH-] = 1 x 10-5 M
pH = - log [H3O+] = - log (1 x 10-5) = 5
4) ما طبيعة تأثير محلول RCOONa في الماء (حمضي، قاعدي، متعادل)؟
قاعدي.
الدورة الصيفية 2011
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1) المادة التي تُعدّ حمضاً حسب مفهوم لويس فقط:
أ) HCl
ب) CN-
ج) HCOOH
د) Cu2+
2) الحمض القوي من الآتية هو:
أ) H2CO3
ب) HNO3
ج) HCN
د) HF
3) المحلول الذي يصلح كمحلول منظم هو:
أ) HCN/NO2-
ب) HNO3/NO3-
ج) H2CO3/HCO3-
د) HClO4/ClO4-
ب) اعتماداً على الجدول المجاور الذي يبين قيم Kb لعدد من محاليل القواعد المتساوية التركيز،
أجب عن الأسئلة الآتية:
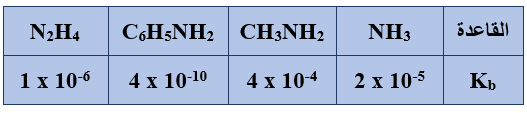
1) ما صيغة الحمض المرافق الأقوى؟
C6H5NH3+
2) اكتب معادلة تفاعل NH3 مع الماء.
NH3 + H2O NH4+ + OH-
3) حدّد الزوجين المترافقين من الحمض والقاعدة في التفاعل الآتي:
CH3NH2 + HF CH3NH3+ + F-
(CH3NH2/CH3NH3+) , (HF/F-)
4) عند تفاعل C6H5NH2 مع NH4+ ، حدد الجهة التي يرجحها الاتزان.
يرجح الاتزان جهة المتفاعلات.
5) احسب قيمة pH لمحلول (0.01 M) من N2H4 . (Kw = 1 x 10-14).
Kb = =
1 x 10-6 =
[OH-] = = 1 x 10-4 M
pOH = - log [OH-] = - log (1 x 10-4) = 4
pH = 14 - 4 = 10
ج) محلول (0.1 M) من الحمض HX حجمه (2 L)، وقيمة pH له تساوي (3)، أضيفت له بلورات من الملح NaX فتغيّرت قيمة pH بمقدار (2). إذا كانت Ka للحمض تساوي 1 x 10-5، أجب عما يلي:
1- ما صيغة الأيون المشترك؟
X-
2- احسب عدد مولات NaX التي أضيفت للمحلول (أهمل التغير في الحجم).
بعد إضافة الملح القاعدي تغيرت قيمة pH بمقدار (2)؛ أي زادت بمقدار (2) فتصبح قيمة pH للمحلول بعض إضافة الملح:
pH = 3 + 2 = 5
[H3O+] = 10-pH = 10-5 = 1 x 10-5 M
Ka =
1 x 10-5 =
[X-] = [NaX] = 0.1 M
n = M x V = 0.1 x 2 = 0.2 mol
الدورة الشتوية 2012
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1) أي الآتية تمثل قاعدة لويس؟
أ) Cu2+
ب) CN-
ج) NH4+
د) HCl
2) الحمض حسب مفهوم برونستد - لوري هو مادة قادرة على:
أ) استقبال بروتون.
ب) منح بروتون.
ج) استقبال زوج إلكترونات.
د) استقبال زوج إلكترونات.
3) أي محاليل الأملاح الآتية قاعدي التأثير؟
أ) HCOONa
ب) NaCl
ج) NH4Cl
د) NaNO3
4) ما حجم محلول KOH تركيزه (0.1 M) اللازم للتعادل تماماً مع (100 mL) من محلول HCl تركيزه (0.2 M)؟
أ) 5 mL
ب) 20 mL
ج) 50 mL
د) 200 mL
ب) يبيّن الجدول الآتي قيم Ka لعدد من محاليل الحموض الضعيفة المتساوية في التركيز، ادرسه ثم أجب عما يأتي:
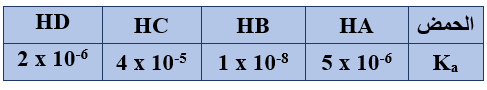
1) اكتب صيغة القاعدة المرافقة الأقوى.
B-
2) اكتب صيغة الحمض الذي لمحلوله أكبر قيمة pH .
HB
3) اكتب صيغة الحمض الذي [OH-] في محلوله هو الأقل.
HA
4) في التفاعل: HD + A- HA + D- حدد الجهة التي يرجحها الاتزان.
يرجح الاتزان جهة المتفاعلات.
5) حدّد الزوجين المترافقين من الحمض والقاعدة في التفاعل:
HA + C- HC + A-
(HA/A-) , (C-/HC)
ج) محلول منظم يتكوّن من: (0.3 M) N2H4 و (0.5 M) N2H5Br ، أجب عما يأتي:
1) اكتب صيغة الأيون المشترك.
N2H5+
2) احسب pH للمحلول بعد إضافة (2 g) من NaOH الصلبة إلى (500 mL) من المحلول المنظم مع إهمال التغير في الحجم.
(الكتلة المولية لـ NaOH = 40 g/mol، Kw = 1 x 10-14 ،Kb لـ N2H4 = 1 x 10-6)
أحسب عدد مولات القاعدة NaOH :
n = = = 0.05 mol
أحسب تركيز القاعدة NaOH :
M = = = 0.1 M
Kb =
1 x 10-6 = =
[OH-] = 1 x 10-6 M
[H3O+] = = = 1 x 10-8 M
pH = -log [H3O+] = -log (1 x 10-8) = 8
الدورة الصيفية 2012
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1) المادة التي تسلك سلوك الحمض وفق مفهوم لويس هي:
أ) Br-
ب) NH3
ج) H2O
د) Cu2+
2) المادة التي تنتج أيونات الهيدروكسيد OH- عند إذابتها في الماء، تُسمى:
أ) حمض أرهينيوس.
ب) حمض لويس.
ج) قاعدة أرهينيوس.
د) قاعدة لويس.
3) أي من محاليل الأملاح الآتية المتساوية في التركيز له أقل pH :
أ) NH4Cl
ب) NaCl
ج) HCOONa
د) KF
4) يتعادل (200 mL) من محلول HBr تركيزه (0.01 M) مع (100 mL) من محلول القاعدة NaOH ، فإن تركيز NaOH (M) يساوي:
أ) 0.01
ب) 0.02
ج) 0.1
د) 0.2
ب) يبيّن الجدول الآتي قيم Kb التقريبية لعدد من محاليل القواعد الضعيفة المتساوية في التركيز، ادرسه ثم أجب عن الأسئلة الآتية:
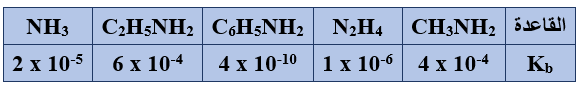
1- ما صيغة القاعدة الأقوى؟
C2H5NH2
2- ما صيغة الحمض المرافق الذي لقاعدته أقل رقم هيدروجيني؟
C6H5NH3+
3- أكمل المعادلة الآتية، ثم حدد الجهة التي يرجحها الاتزان:
CH3NH3+ + NH3 ........... + ...........
CH3NH3+ + NH3 CH3NH2 + NH4+
يرجح الاتزان جهة المتفاعلات.
4- احسب [OH-] في محلول N2H4 الذي تركيزه (0.04 M).
N2H5+ + OH- N2H4 + H2O
Kb = =
1 x 10-6 =
[OH-] = = 2 x 10-4 M
[H3O+] = = = 5 x 10-9 M
pH = -log [H3O+] = -log (5 x 10-9) = 8.3
ج) محلول منظم حجمه (1 L)، مكوّن من الحمض الافتراضي HX (0.1 M) وملحه NaX (0.2 M). إذا علمت أن Ka للحمض HX = (1 x 10-5)، وأن (log 5 = 0.7)،
أجب عما يأتي:
1- اكتب صيغة الأيون المشترك.
X-
2- احسب الرقم الهيدروجيني pH للمحلول.
X- + H3O+ HX + H2O
Na+ + x- NaX
Ka =
1 x 10-5 =
[H3O+] = 0.5 x 10-5 = 5 x 10-6 M
pH = -log [H3O+] = -log (5 x 10-6) = 5.3
3- احسب تركيز حمض HCl اللازم إضافته للمحلول ليصبح pH = 5 (مع إهمال التغير في الحجم).
[H3O+] = 10-pH = 10-5 = 1 x 10-5 M
Ka =
1 x 10-5 =
x = [HCl] = 0.05 M
الدورة الشتوية 2013
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1- الحمض وفق مفهوم برونستد - لوري هو مادة:
أ) مانحة للإلكترون.
ب) مانحة للبروتون.
ج) مستقبلة للإلكترون.
د) مستقبلة للبروتون.
2- أي الآتية تعد قاعدة وفق مفهوم لويس؟
أ) Zn2+
ب) HF
ج) NH3
د) Na+
3- أي الآتية فشل مفهوم أرهينيوس في تفسير السلوك الحمضي أو القاعدي لمحلوله المائي؟
أ) HF
ب) NaF
ج) NaOH
د) HCOOH
4- أي الآتية يصلح كمحلول منظم:
أ) HNO3/NaNO2
ب) HNO2/NaNO3
ج) HNO3/NaNO3
د) H2SO3/NaHSO3
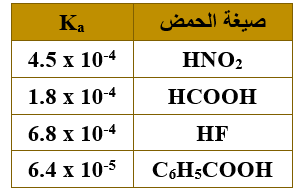 ب) يبين الجدول الآتي قيم ثابت التأين (Ka) لعدد من الحموض الضعيفة المتساوية التركيز. ادرس الجدول، ثم أجب عما يأتي:
ب) يبين الجدول الآتي قيم ثابت التأين (Ka) لعدد من الحموض الضعيفة المتساوية التركيز. ادرس الجدول، ثم أجب عما يأتي:
1- ما صيغة القاعدة المرافقة الأضعف؟
F-
2- ما صيغة الحمض الذي لمحلوله أكبر قيمة pH ؟
C6H5COOH
3- أكمل التفاعل الآتي:
C6H5COO- + HF …….. + ……..
C6H5COO- + HF C6H5COOH + F-
4- حدد الزوجين المترافقين من الحمض والقاعدة والجهة التي يرجحها الاتزان في التفاعل الآتي:
HCOOH + NO2- HCOO- + HNO2
الأزواج المترافقة: (HCOOH/HCOO-) , (HF/F-)
يرجح الاتزان جهة المتفاعلات.
5- أي الحمضين (HNO2 ، HF) تركيز OH- في محلوله أكبر؟
HNO2
ج) فسّر بالمعادلات فقط الأثر القاعدي لمحلول الملح NaNO2 .
NaNO2 Na+ + NO2-
NO2- + H2O HNO2 + OH-
د) محلول منظم حجمه (0.5 L) مكون من الحمض HCOOH تركيزه (0.3 M) والملح HCOOK تركيزه (0.3 M)، وبعد إضافة بلورات من KOH الصلبة أصبحت قيمة pH للمحلول = 4 (أهمل التغير في الحجم).
إذا علمت أن (Ka للحمض HCOOH = 2 x 10-4 ، الكتلة المولية لـ KOH = , 56 g/mol Kw = 1 x 10-14)
أجب عما يأتي:
1- ما صيغة الأيون المشترك في المحلول؟
HCOO-
2- احسب كتلة KOH التي أضيفت للمحلول.
[H3O+] = 10-pH = 10-4 = 1 x 10-4 M
Ka =
2 x 10-4 =
2 =
0.6 - 2x = 0.3 + x
0.6 - 0.3 = x + 2x
3x = 0.3
x = 0.1 M = [KOH]
n = M x V = 0.1 x 0.5 = 0.05 mol
m = n x Mr = 0.05 x 56 = 2.8 g
الدورة الصيفية 2013
أ) انقل إلى دفتر إجابتك رقم الفقرة والإجابة الصحيحة لها:
1- إن إضافة الملح HCOONa إلى محلول حمض الميثانويك HCOOH تؤدي إلى:
أ) زيادة pH .
ب) خفض pH .
ج) زيادة [H3O+] .
د) خفض [OH-] .
2- المادة التي تُنتج أيونات H+ عند إذابتها في الماء تُسمّى:
أ) حمض برونستد - لوري
ب) قاعدة لويس
ج) قاعدة أرهينيوس
د) حمض أرهينيوس
3- المادة التي تسلك سلوك القاعدة وفق مفهوم لويس هي:
أ) BF3
ب) Fe3+
ج) NH3
د) NaOH
4- المحلول الذي يصلح كمحلول منظم من بين المحاليل الآتية، هو:
أ) KClO4/HClO4
ب) NaNO3/HNO3
ج) NaCl/HCl
د) CH3NH2/CH3NH3Br
ب) اعتماداً على الجدول التالي الذي يمثل عدد من المحاليل الافتراضية وقيم pH لها، أجب عن الأسئلة التي تليه:
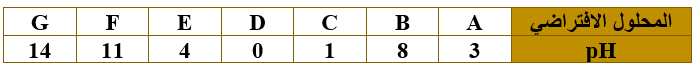
1- اختر من الجدول الرمز الذي يمثّل:
أ- محلول الحمض الأقوى.
D
ب- محلول قاعدة فيها [OH-] يساوي 1 x 10-6 M
B
ج- محلول NaOH
G (إذا كان تركيز القاعدة 1 M).
د- محلول حمض فيه [H3O+] يساوي 1 x 10-3 M
A
2- أي المحلولين (E ، C) له أكبر قيمة Ka ؟
C
3- إذا كان تركيز المحلول (F) يساوي (0.2 M)، احسب قيمة Kb لهذا المحلول.
[H3O+] = 10-pH = 10-11 = 1 x 10-11 M
pOH = 14 - 11 = 3
[H3O+] = 10-pOH = 10-3 = 1 x 10-3 M
Kb = =
Kb = = 5 x 10-6
ج) أكمل التفاعل التالي، ثم حدّد الزوجين المترافقين من الحمض والقاعدة.
N2H4(aq) + H2O(l) OH- + ……….
N2H4(aq) + H2O(l) OH- + N2H5+
الزوجين المترافقين: (N2H4/N2H5+) , (H2O/OH-)
د) محلول منظم حجمه (1 L)، مكوّن من الحمض HCN تركيزه (0.1 M)، والملح NaCN تركيزه (0.5 M). (إذا علمت أن Ka للحمض HCN = 1 x 10-4)، أجب عما يأتي:
1- ما صيغة الأيون المشترك في المحلول؟
CN-
2- احسب [H3O+] في المحلول.
Ka =
1 x 10-4 =
[H3O+] = 2 x 10-5 M
3- احسب تركيز [NaOH] اللازم إضافتها للمحلول لتصبح قيمة pH = 4 (مع إهمال تغيّر الحجم).
[H3O+] = 10-pH = 10-4 = 1 x 10-4 M
Ka =
1 x 10-4 =
1 =
0.1 - x = 0.5 + x
0.1 - 0.5 = x + x
2x = -0.4
x = -0.2 M = [NaOH] (لايجوز أن يكون التركيز سالباً)
إعداد : شبكة منهاجي التعليمية
26 / 01 / 2023
النقاشات