قانون شارل
’s Law Charle
ماذا يحدث لحجم البالون المثبت على فوهة زجاجة موضوعة في ماءٍ ساخن؟
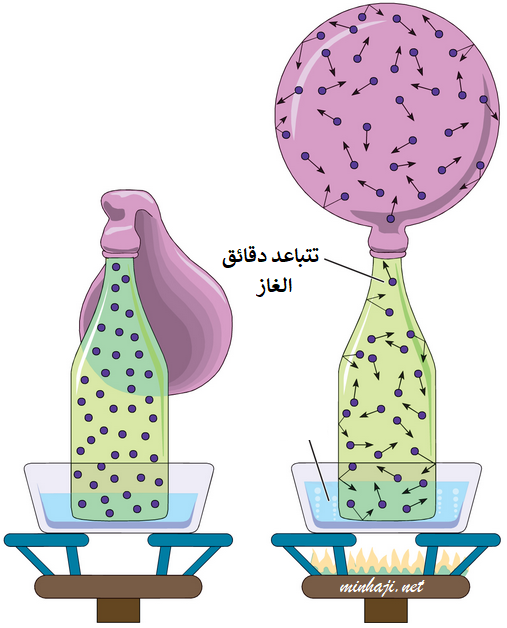
زيادة درجة حرارة الغاز تؤدي إلى زيادة متوسط الطاقة الحركية للجزيئات، فتزداد سرعتها، وتاخذ بالتباعد فيزداد حجم الغاز.
اكتشف العالم الفرنسي شارل العلاقة بين حجم الغاز ودرجة حرارته، فعند زيادة درجة حرارة الغاز يزداد حجمه عند ثبات ضغطه.
نص قانون شارل:
"حجم كمية محددة من الغاز المحصور يتناسب طردياً مع درجة حرارته المطلقة عند ثبات ضغطه".
تفسير قانون شارل استناداً إلى نظرية الحركة الجزيئية:
عند زيادة درجة الحرارة تزداد الطاقة الحركية لجزيئات الغاز، فتزداد المسافة بين الجزيئات، وبسبب ثبات الضغط فإن حجم الغاز يزداد.
اشتقاق القانون
يُعبّر عن قانون شارل رياضيّاً على النحو الآتي:
عند ثبات الضغط (P) فإن حجم الغاز (V) يتناسب طردياً مع درجة حرارته المطلقة (T):
V T
وبتحويل إشارة التناسب إلى إشارة مساواة نضرب في ثابت (k):
V = k T
وبترتيب حدود العلاقة:
k =
فلو كان لدينا ظرفان مختلفان للغاز، يكون:
k =
k =
وبمساواة الحدين، نحصل على قانون شارل:
=
عند تطبيق قوانين الغازات يجب تحويل درجة الحرارة السيليزية إلى مطلقة من خلال العلاقة:
درجة الحرارة المطلقة = الدرجة السيليزية + 273
وتقاس الدرجة المطلقة بوحدة الكلفن.
أمثلة محلولة
مثال (1):
تشغل كتلة من غاز الكلور حجماً قدره 60 mL عند درجة حراره 270C. أحسب حجمها عندما تزداد درجة حرارتها بمقدار 200C، مع بقاء الضغط ثابتاً.
تحليل السؤال (المعطيات)
T1 = 27 + 273 = 300 K
T2 = 320 K
V1 = 60 mL
V2 = ??
الحل:
=
=
V2 = 64 mL
مثال (2):
كمية من الغاز تشغل حجماً مقداره 5 L، بدرجة 270C، احسب الدرجة الحرارية (بوحدة السيليسيوس) التي يتضاعف عندها حجم الغاز عند ثبات الضغط.
تحليل السؤال (المعطيات)
T1 = 27 + 273 = 300 K
T2 = ??
V1 = 5 L
V2 = 10 L
الحل:
=
=
T2 = 600 K
ولتحويل درجة الحرارة من مطلق إلى سيليسيوس:
درجة الحرارة = 600 - 273 = 3270C
أتحقق صفحة (61):
عينة من غاز النيتروجين حجمها 430 mL عند 240C ، عند أي درجة حرارة يصبح حجمها 0.75 L بفرض ثبات الضغط؟
تحليل السؤال (المعطيات)
T1 = 24 + 273 = 297 K
T2 = ??
V1 = 430 mL = 0.43 L
V2 = 0.75 L
الحل:
=
=
T2 = 518 K
T2 = 518 – 273 = 2450C
إعداد : أ. أحمد الحسين
02 / 11 / 2022
النقاشات