قانون الغاز المثالي
Ideal Gas Law
قانون الغاز المثالي قانون يجمع بين أربع كميات: الضغط والحجم ودرجة الحرارة وعدد المولات.
اشتقاق القانون
V n
V
V T
V n x
V = R x
PV = n R T
تسمى العلاقة (PV = n R T) قانون الغاز المثالي؟
حيث R : ثابت الغاز العام، ويساوي (0.082L.atm/mol.K)
مثال (1):
احسب ضغط 0.5 mol من غاز الأكسجين محصوراً في وعاء حجمه 4 L عند درجة 107o C . اعتبر ثابت الغاز العام يساوي 0.08 L.atm/mol.K.
تحليل السؤال (المعطيات)
n = 0.5 mol
V = 4 L
P = ??
T = 107 + 273 = 380 K
R = 0.08 L.atm/mol.K
الحل:
PV = n RT
P x 4 = 0.5 x 0.08 x 380
P = 3.8 atm
وإذا أعطيت في السؤال كتلة الغاز (m) وكتلته المولية (Mr) يمكن حساب عدد مولاته من خلال العلاقة:
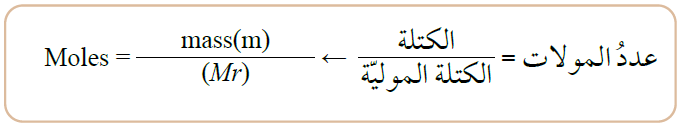
ويصبح قانون الغاز المثالي:
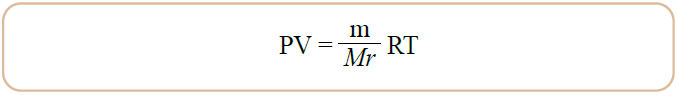
مثال (2):
ما الحجم الذي تشغله عينة من غاز النيتروجين N2 كتلتها 56 g عند درجة 270C، وضغط 1.2 atm. اعتبر ثابت الغاز العام يساوي 0.08 L.atm/mol.K، الكتلة المولية لـ N2 يساوي 28 g/mol.
تحليل السؤال (المعطيات)
m = 56 g
Mr = 28 g/mol
n = ??
V = ??
P = 1.2 atm
T = 27 + 273 = 300 K
R = 0.08 L.atm/mol.K
الحل:
نحسب عدد مولات الغاز من كتلة الغاز وكتلته المولية:
n = = = 2 mol
PV = n RT
1.2 x V = 2 x 0.08 x 300
V = 40 L
ويمكن استخدام قانون الغاز المثالي لاشتقاق قانون لحساب كثافة الغاز:

مثال (3):
أحسب كثافة غاز الفلور F2 بوحدة (g/L) عند درجة 25oC، وضغط 0.85 atm. إذا علمت أن ثابت الغاز العام يساوي 0.082 L.atm/mol.K، الكتلة المولية لـ F2 يساوي 38 g/mol.
تحليل السؤال (المعطيات)
d = ??
P = 0.82 atm
T = 25 + 273 = 298 K
R = 0.082 L.atm/mol.K
Mr = 38 g/mol
الحل:
d = Mr x
d =
d = 1.32 g/L
سؤال (1):
عند أي ضغط سوف يشغل 0.25 mol من غاز النيتروجين N2 حجماً مقداره 10 L عند درجة 100oC .
اعتبر ثابت الغاز العام يساوي 0.08 L.atm/mol.K.
الجواب النهائي: 0.765 atm
سؤال (2):
بالون حجمه 2400 L مملوء بغاز الهيليوم He عند ضغط = 1 atm ودرجة حرارة = 270 C . ارتفع إلى أعلى حيث درجة الحرارة = -230 C ولكي يبقى الحجم ثابتاً تم التخلص من 80 g من الهيليوم. أحسب ضغط الغاز في البالون بعد ارتفاعه للأعلى. إعتبر ثابت الغاز العام (R) = 0.08 L.atm/mol.K والكتلة المولية للهيليوم = 4 g/mol.
الجواب النهائي: 0.66 atm
سؤال (3):
تحتوي إسطوانة حجمها 40 L على الغاز (A) عند درجة حرارة 270 C . فإذا كانت الكتلة المولية للغاز (A) تساوي 30 g/mol فاحسب كتلة الغاز المتبقي في الاسطوانة بعد تسرب كمية منه بحيث أصبح الضغط داخل الاسطوانة = 12 atm عند درجة الحرارة نفسها . (اعتبر ثابت الغاز العام 0.08 L.atm/mol.K).
الجواب النهائي: 600 g
إعداد : أ. أحمد الحسين
02 / 11 / 2022
النقاشات