إجابات أسئلة مراجعة الدرس
الحالة الغازية
السؤال الأول:
الفكرة الرئيسة: ما المقصود بكلّ ممّا يأتي:
الغاز المثالي، الضغط الجزئي للغاز، التدفق.
الغاز المثالي: غاز افتراضي حجم جُسيماته يساوي صفراً وقوى التجاذب بينها معدومة.
الضغط الجزئي للغاز: الضغط الذي يؤثر به الغاز في خليط من الغازات غير المتفاعلة.
التدفق: تسرب الغاز المضغوط من فتحة صغيرة.
السؤال الثاني:
أفسّر: تتشابه الغازات في خصائصها الفيزيائية.
لأن جسيمات الغاز متباعدة جداً وقوى التجاذب بينها شبه معدومة.
السؤال الثالث:
أقارن: أحدد الغاز الأسرع انتشاراً: النيتروجين N2 أم الآرغون Ar .
سرعة انتشار غاز النيتروجين أكبر؛ لأن كتلته المولية أقل.
السؤال الرابع:
أصف: عينة غاز الهيدروجين في الظروف المعيارية، نقلت إلى وعاء أصغر حجماً عند درجة الحرارة نفسها، فما التغير الذي يحدث لكلّ من:
- متوسط الطاقة الحركية لجزيئات H2 .
متوسط الطاقة الحركية لا تتغير.
- عدد التصادمات الكلية لجزيئات غاز H2 خلال وحدة الزمن.
يزداد.
- ضغط غاز H2 .
يزداد.
السؤال الخامس:
أفسّر: استخدم أحد الطلبة البيانات الآتية T2 = -15oC , T1 = 75oC , V1 = 752 mL لحساب V2 لأحد الغازات، وكانت إجابته V2 = -150.4 mL . ما الخطأ الذي ارتكبه الطالب خلال حساب قيمة V2 ؟
قيمة المحسوبة غير مقبولة؛ لأن الحجم المحسوب له قيمة سالبة؛ والخطأ الذي وقع فيه الطالب هو عدم تحويل درجة الحرارة من oC إلى درجة الحرارة المطلقة.
السؤال السادس:
أحسب: إذا علمت أن بالوناً مملوءاً بغاز الهيليوم حجمه 300 mL عند ضغط 1 atm ، ارتفع إلى أعلى بحيث أصبح الضغط 0.63 atm ، فاحسب حجمه الجديد بفرض بقاء درجة الحرارة ثابتة.
P1 V1 = P2 V2
1 x 300 = 0.63 x V2
V2 = 476.2 L
السؤال السابع:
أحسب: عينة من غاز حجمها 3.5 L عند درجة 200 C وضغط 0.86 atm . احسب درجة حرارتها إذا سمح لها بالتمدد حتى أصبح حجمها 8 L عند ضغط 0.56 atm .
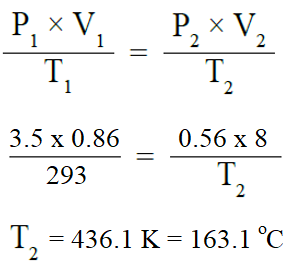
السؤال الثامن:
أحسب: أنتج تفاعل ما 5.67 g من غاز CO2 . أحسب حجم الغاز عند درجة حرارة 23o C وضغط يساوي 0.985 atm . (الكتلة المولية للغاز = 44 g/mol)
نحسب عدد مولات (n) الغاز بقسمة كتلته على كتلته المولية:
n = m / Mr
n = 5.67 / 44 = 0.13 mol
نحول درجة الحرارة إلى المطلق:
T = 23 + 273 = 296 K
نحسب الضغط من قانون الغاز المثالي:
P V = n R T
0.985 x V = 0.13 x 0.082 x 296
V = 3.2 L
السؤال الثاني عشر:
أحسب: بالون حجمه 2400 L مملوء بغاز الهيليوم He عند ضغط يساوي 1 atm ودرجة حرارة = 270 C ، ارتفع إلى أعلى حيث درجة الحرارة = -230 C ، ولكي يبقى حجمه ثابتاً جرى التخلص من 80 g من الهيليوم. احسب ضغط الغاز في البالون بعد ارتفاعه للأعلى. إعتبر ثابت الغاز العام (R) = 0.08 L.atm/mol.K والكتلة المولية للهيليوم = 4 g/mol.
|
معطيات البالون في الأسفل |
|
معطيات البالون في الأعلى |
||
|
1 atm |
P |
|
?? |
P |
|
2400 L |
V |
|
2400 L |
V |
|
?? |
n |
|
?? |
n |
|
27 + 273 = 300 K |
T |
|
-23 + 273 = 250 K |
T |
|
0.08 L.atm/mol.K |
R |
|
0.08 L.atm/mol.K |
R |
أولاً: نحسب عدد مولات غاز الهيليوم في البالون في الأسفل من قانون الغاز المثالي:
PV = n RT
1 x 2400 = n x 0.08 x 300
n = 100 mol
ثانياً: نحسب عدد مولات غاز الهيليوم المتسرب من البالون:
n = 80 / 4 = 20 mol
ثالثاً: نحسب عدد مولات غاز الهيليوم المتبقى في البالون في الأعلى بعد التسرب:
n = 100 – 20 = 80 mol
رابعاً: نحسب ضغط غاز الهيليوم في البالون في الأعلى من قانون الغاز المثالي:
PV = n RT
P x 2400 = 80 x 0.08 x 250
P = 0.66 atm
إعداد : شبكة منهاجي التعليمية
02 / 11 / 2022
النقاشات