قانون دالتون للضغوط الجزئية
Dalton’s Law of Partial Pressure
تختلط الغازات مع بعضها لوجود مسافات بينية كبيرة بين جسيمات الغاز، ما يسمح لجسيمات الغاز بالانتشار بين فراغات بعضها.
لاحظ العالم دالتون عند وضع عدد من الغازات لا تتفاعل مع بعضها في وعاء أن كل غاز يؤثر على جدران الوعاء بضغط مساوٍ لضغط الغاز نفسه لو وضع في وعاء مستقل عند ثبات الحرارة والحجم؛ أي أن لكل غاز ضغط مستقل يسمى الضغط الجزئي للغاز، واستنتج دالتون أن الضغط الكلي لخليط من الغازات التي لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزئية للغازات المكونة للخليط.
نص قانون دالتون
"الضغط الكلي لخليط من الغازات التي لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزئية لجميع مكونات الخليط".
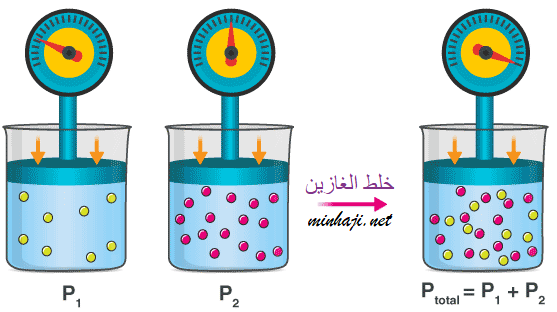
العلاقة الرياضية لقانون دالتون

مثال (1):
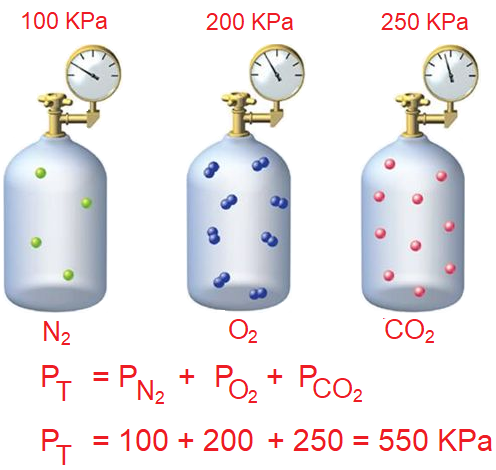
احسب الضغط الكلي لخليط من الغازات مكون من غاز النيتروجين الذي ضغطه الجزئي 100KPa ، وغاز الأكسجين الذي ضغطه الجزئي 200KPa ، وغاز ثاني أكسيد الكربون الذي ضغطه الجزئي 250KPa.
تحليل السؤال (المعطيات)
PN2 = 100 KPa
PO2 = 200 KPa
PCO2 = 250 KPa
PT = ??
الحل:
PT = PN2 + PO2 + PCO2
PT = 100 + 200 + 250 = 550 KPa
أتحقق صفحة (74):
إذا علمت أن 2 L من غاز النيتروجين N2 ضغطه 0.395 atm و 2 L من غاز الهيدروجين H2 ضغطه 0.11 atm خلطت في وعاء واحد حجمه 1 L ، فاحسب الضغط الكلي للخليط.
تحليل السؤال (المعطيات)
بما أن حجم كل من الغازين قل إلى النصف، فإن ضغط كل منهما سيزداد إلى الضعف.
الحل:
PN2 = 2 x 0.395 = 0.79 atm
PH2 = 2 x 0.11 = 0.22 atm
PT = 0.79 + 0.22 = 1.01 atm
طريقة أخرى للحل:
يمكن حساب الضغط الجزئي لكل غاز من قانون بويل، ثم جمع الضغطين الناتجين.
إعداد : أ. أحمد الحسين
06 / 11 / 2021
النقاشات